|
La FORMATION d'ESPÈCES
Preuves absolues sous nos yeux
 | Autres
preuves |  |
 L'évolution
est un processus en cours, mais observer l'évolution - ou une spéciation
(la formation d'une nouvelle espèce) - du début à la fin
de son processus est plus que difficile: le temps dont dispose chaque humain est
très bref, une vie.
L'évolution
est un processus en cours, mais observer l'évolution - ou une spéciation
(la formation d'une nouvelle espèce) - du début à la fin
de son processus est plus que difficile: le temps dont dispose chaque humain est
très bref, une vie.
Ce temps d'observation bien trop court limite
l'humain soit à expérimenter sur des espèces à fécondité
rapide telles les souris et les mouches, ultra-rapide tels les micro-organismes
; soit à observer l'évolution à travers ses résultantes
sur les organes et organismes ; soit à se contenter des descendants d'intermédiaires
structuraux - comme ceux abordés dans les chapitres précédents
- qui tous démontrent l'évolution.
De flagrantes spéciations
en cours peuvent cependant être observées tout autour de nous,
notamment dans la flore et faune de certaines îles, par des sous-espèces
isolées géographiquement entre elles qui ont déjà
"instauré" une barrière précopulatoire: le chant
de certaines
populations d'oiseaux a tant divergé qu'il n'est plus attractif pour la
femelle de l'espèce souche. D'autres enfin, sans isolement géographique,
ont subi une altération de leur comportement rendant leur reproduction
avec l'espèce souche plus qu'improbable.
Des exemples de processus
dénotant d'une spéciation en cours ne sont pas rares : ils sont
observables à chaque instant, un peu partout, loin et près de nous,
dans les populations vivantes et jusqu'en laboratoire, à l'intérieur
d'autres organismes...
Malgré
cela, quelques exemples de spéciations terminées
côtoyant l'espèce souche (=> preuve absolue d'évolution
!) ont pu être observées sur une période de temps historique,
dont un humain peut témoigner. Celles présentées dans cette
page confinent pour certaines de l'évolution par « sauts »,
ou changements brusques sur le phénotype suite à des remaniements
chromosomiques, des altérations de gènes du développement,
l'expression de nouvelles protéines et enzymes, etc. Pour d'autres elles
relèveraient plutôt de "micro-évolutions", ou modifications
alléliques au sein des populations, des changements de stratégies
de reproduction, etc.
Mais tous ces exemples de spéciations ont un
point commun: ce sont des passages d'une espèce souche à une nouvelle
espèce visibles, vérifiables
et indéniables, car ces
nlles espèces et leur souche sont encore en vie.
Un
exemple de spéciation en cours
Preuve absolue, observée à la campagne, de l'évolution
 La souris sylvestre américaine (Peromyscus
maniculatus) forme un flux génétique entre 4 populations
distinguées en sous-espèces (P maniculatus
borealis, P m nebrascensis, P m sonorienses, et P m artemisiae). Celles-ci
sont morphologiquement assez ressemblantes, vivent dans des régions différentes,
mais se côtoient en certaines zones.
La souris sylvestre américaine (Peromyscus
maniculatus) forme un flux génétique entre 4 populations
distinguées en sous-espèces (P maniculatus
borealis, P m nebrascensis, P m sonorienses, et P m artemisiae). Celles-ci
sont morphologiquement assez ressemblantes, vivent dans des régions différentes,
mais se côtoient en certaines zones. La
particularité de ces 4 populations est leur interfécondité
conditionnelle, appelée parfois cline. Conditionnelle car certaines populations
peuvent se reproduire avec d'autres, mais certaines ne le peuvent plus. Le flux
génétique faible allant d'une variété géographique
à l'autre extrême est discontinu. Il suffirait donc que les sous
espèces par lesquelles le flux génétique passe s'éteignent
un jour (P maniculatus nebrascensis
et sonorienses), pour
qu'il ne reste plus que les deux sous-espèces incapables de se croiser
entre elles : P maniculatus borealis
et artemisiae. N'ayant
plus de flux génétique entre elles, ces dernières formeraient
alors deux espèces biologiques ou génétiques distinctes.
Le schéma ci-dessous explique clairement la problématique. (Exemple
de spéciation inachevée/flux génétique transmis par
Hans, que nous remercions). 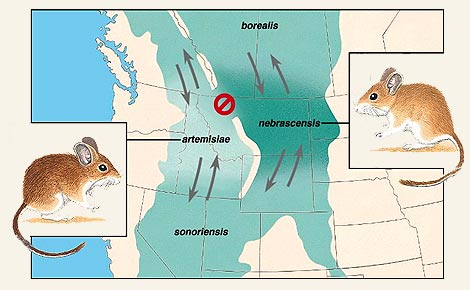
(
Survolez avec votre souris les zones des différentes populations de...
souris )
Évolution
sur une période de quelques décennies
Preuve absolue, observée à la campagne, de l'évolution
 Le crapaud géant ou marin, (Bufo marinus),
introduit il y a 70 ans en Australie pour y lutter contre les ravageurs de la
canne à sucre, poursuit ses ravages contre la faune locale et accélère
même sa progression, préviennent des chercheurs dans la revue Nature
à paraître jeudi.
Le crapaud géant ou marin, (Bufo marinus),
introduit il y a 70 ans en Australie pour y lutter contre les ravageurs de la
canne à sucre, poursuit ses ravages contre la faune locale et accélère
même sa progression, préviennent des chercheurs dans la revue Nature
à paraître jeudi. Ce
crapaud à la peau jaune et grumeleuse, qui peut atteindre un poids de 2
kg, voit ses pattes grandir en Australie, ce qui lui permet de conquérir
de nouveaux territoires de plus en plus rapidement, selon une équipe de
zoologistes de l'université de Sydney, dirigés par Richard Shine.
Plus grand batracien
du monde, originaire des Antilles, toxique, et qui pond de 5.000 à 10.000
oeufs par an, cet animal appelé aussi crapaud buffle ou bufo géant
a été introduit en Australie pour éliminer les insectes attaquant
la canne à sucre. Il occupe désormais plus d'un million de kilomètres
carrés où il s'attaque à la faune locale (autres batraciens,
reptiles, rongeurs), la faisant disparaître. Or
les chercheurs ont constaté que les nouvelles générations
ont des pattes plus longues que leurs ancêtres, ce qui leur permet de
progresser d'autant plus vite. Les zoologistes ont étudié le déplacement
de ces crapauds à 60 km à l'est de Darwin, dans le nord du pays
: les premiers à arriver aux points de contrôle, qui avaient parcouru
jusqu'à 1,8 km par nuit, avaient des membres plus longs que ceux parvenus
plus tard.
Selon les chercheurs, ce changement de morphologie explique pourquoi
la vitesse de progression du crapaud marin s'est nettement accélérée
au fil des années, passant de 10 km par an entre les années 1940
et 1960 à 50 km par an actuellement.
«
Ces changements rapides dans la morphologie du crapaud, sa vitesse de locomotion
et sa rapidité à occuper de nouveaux territoires, montrent que les
biologistes et les gestionnaires spécialisés dans la conservation
des espèces devraient examiner avec attention la possibilité qu'ont
des organismes envahissants de s'adapter rapidement », estiment les chercheurs.
(Agence France-Presse, Paris, 2006) 
Évolution
sur une période de 11 ans
Preuve absolue, observée en aquarium, de l'évolution
Les guppies, petits poissons tropicaux bien connus
des aquariophiles, peuvent évoluer, en cas de crise (pollution, augmentation
de la population de prédateurs, destruction du milieu, etc.), entre
dix mille et dix millions de fois plus vite que
le cours normal de l'évolution. C'est ce que vient de démontrer
le biologiste David Reznick, de l'université de Californie, à
Riverside (Etats-Unis).
Le chercheur a étudié plusieurs populations
de guppies de l'île de la Trinité, aux Antilles. Les poissons, qui
se déplacent de bassin en bassin pour échapper à leurs prédateurs
(notamment les cichlidés), évoluent à une vitesse surprenante:
en dix-huit générations - soit onze ans - les guppies qui ont trouvé
un "havre de paix" sont devenus plus gros et plus colorés que
ceux, plus petits et plus fertiles, qui étaient constamment soumis à
la menace de prédateurs.
(réf: La Recherche, 2002) 
Évolution
sur une période de 20 ans
Preuve absolue, observée dans un lac, de l'évolution
Le processus qu’est l’évolution
biologique est l’un des plus lents de la nature. L’intervention de l’homme
peut cependant induire une accélération de ce processus. C’est
ce que suggère une étude menée sur une espèce de poisson,
dénommée Cynotilapia afra.
Chez
beaucoup d’animaux, la formation de nouvelles espèces prend des milliers
d’années. Les poissons cichlidés sont pour leur part connus
pour avoir un rythme rapide d’évolution. Les cichlidés du Lac
Malawi (Afrique) auraient engendré 1000 espèces en seulement 500.000
ans.
Dans les années
60, des individus de l’espèce Cynotilapia afra ont été
involontairement introduits dans le Mitande Point, un site du Thumbi West, une
île du lac. En 1983, l’espèce n’avait pas bougé
du Mitande Point. Mais lorsque J. Todd Streelman et ses collègues
du Georgia Institute of Technology vinrent sur l’île en 2001, la situation
avait changé : Cynotilapia afra avait
évolué, en moins de vingt ans, en deux populations génétiquement
distinctes et différemment colorées, une située
dans la partie nord de l’île et l’autre dans la partie sud.
Il s’agit d’un
exemple fort d’évolution induite par l’homme, constate Streelman.
Ce cas s’ajoute à une liste incluant le saumon, les mouches et les
plantes, pour lesquels l’action humaine a induit une évolution à
un rythme qui n’avait jamais été observé auparavant.
(réf : L’étude
sur le sujet est publiée dans l ‘édition du 13 août 2004
de la revue Molecular Ecology.) 
Formation
d'espèces en laboratoire
Preuves
absolues, observées en labo, de l'évolution  Harryton L. Carson a proposé
un modèle de spéciation par un individu fondateur, une espèce
fécondée par ex., capable de produire de nombreux descendants sexués,
qui arrive par hasard dans un environnement oì il n'existe pas de compétition
avec les espèces concurrentes. Ce modèle propose l'alternance de
phases d'expansion et de réduction des effectifs. C'est ainsi que les îles
Hawaï, colonisées vraisemblablement lors de tempêtes par des
drosophiles venant du continent, ont rapidement donné de nouvelles espèces.
Harryton L. Carson a proposé
un modèle de spéciation par un individu fondateur, une espèce
fécondée par ex., capable de produire de nombreux descendants sexués,
qui arrive par hasard dans un environnement oì il n'existe pas de compétition
avec les espèces concurrentes. Ce modèle propose l'alternance de
phases d'expansion et de réduction des effectifs. C'est ainsi que les îles
Hawaï, colonisées vraisemblablement lors de tempêtes par des
drosophiles venant du continent, ont rapidement donné de nouvelles espèces.
Mais comment le vérifier ?
J.
R. Powell suivit donc le protocole d'expérience suivant : A.
Un lot de 4 populations séparées de Drosophiles (Drosophila
pseudoobscura) placées dans des cages à populations
(20 femelles et 20 mâles) fut mis dans les conditions permettant une expansion
rapide.
Puis au maximum de l'expansion, on provoqua un étranglement
artificiel des effectifs en choisissant 12 couples pour former 12 nouvelles populations
fondatrices qui subirent une nouvelle expansion.
=> 15 générations
après le premier étranglement des effectifs, les tests d'isolement
reproductif ont montré que sur 45 combinaisons une seule montrait quelque
degré d'isolement comportemental.
B.
8 des 12 populations furent ensuite soumises à trois nouveaux cycles d'expansion-étranglement.
=> 15 générations
après le dernier étranglement d'effectif, on n'observa pas d'isolement
post-accouplement, mais 3 des 8 pepulations fondatrices montraient un isolement
comportemental pré-copulatoire qui se maintint ultérieurement.
Des populations de contrôle, non soumises aux alternances expansion-étranglement,
n'ont montré aucune trace d'isolement reproductif. Cet
exemple illustre la très grande importance de la réduction des
effectifs dans le phénomène de divergence évolutive,
puis de spéciation...
(C. Devillers - J. Chaline, La Théorie de l'évolution,
Bordas, 1989) Naissance
d'espèces observée sur le terrain
Preuve absolue, observée
dans la nature, de l'évolution  En 1970, la preuve tant
recherchée d'une naissance d'espèce dans la nature est enfin observée.
Thomas Dobzhansky et
ses collaborateurs (dont notamment Francisco Ayala) ont pu observer tous les stades
de la différenciation génétique menant de la variété
à l'espèce, dans un groupe d'espèces de drosophiles d'Amérique
du Sud, appelé le groupe de Drosophila willistoni
(d'après le nom de l'une d'elles qui semble avoir été
l'espèce-souche).
En 1970, la preuve tant
recherchée d'une naissance d'espèce dans la nature est enfin observée.
Thomas Dobzhansky et
ses collaborateurs (dont notamment Francisco Ayala) ont pu observer tous les stades
de la différenciation génétique menant de la variété
à l'espèce, dans un groupe d'espèces de drosophiles d'Amérique
du Sud, appelé le groupe de Drosophila willistoni
(d'après le nom de l'une d'elles qui semble avoir été
l'espèce-souche).
Ces
stades comprenaient, dans l'ordre de différenciation génétique
croissante, la variété locale, la race, la sous-espèce, la
semi-espèce, l'espèce naissante ou espèce jumelle (car encore
indistinguable morphologiquement de l'espèce-souche, bien que ne se croisant
plus avec elle), puis l'espèce nouvelle morphologiquement distincte.
 Francisco
Ayala a même pu chiffrer le degré de divergence génétique
de chacun des stades, en estimant la proportion de gènes dans leur
patrimoine génétique ayant subi le processus de remplacement de
variantes génétiques par d'autres. Ainsi, dans le groupe de Drosophila
willistoni, les variétés locales ou les races n'avaient subi
de processus de remplacement d'allèles (variantes génétiques)
qu'au niveau de 3 gènes sur 100, en moyenne. Les sous-espèces avaient
subi un remplacement d'allèles au niveau de 23 % des gènes; les
semi-espèces présentaient pratiquement le même chiffre (ce
qui s'explique par le fait qu'une semi-espèce diffère surtout d'une
sous-espèce par le comportement de préférence sexuelle pour
des partenaires appartenant à la même semi-espèce, comportement
dont le déterminisme génétique ne met probablement en jeu
que peu de gènes). Chez les espèces " jumelles", un remplacement
d'allèles s'était produit au niveau de 58 gènes sur 100. Francisco
Ayala a même pu chiffrer le degré de divergence génétique
de chacun des stades, en estimant la proportion de gènes dans leur
patrimoine génétique ayant subi le processus de remplacement de
variantes génétiques par d'autres. Ainsi, dans le groupe de Drosophila
willistoni, les variétés locales ou les races n'avaient subi
de processus de remplacement d'allèles (variantes génétiques)
qu'au niveau de 3 gènes sur 100, en moyenne. Les sous-espèces avaient
subi un remplacement d'allèles au niveau de 23 % des gènes; les
semi-espèces présentaient pratiquement le même chiffre (ce
qui s'explique par le fait qu'une semi-espèce diffère surtout d'une
sous-espèce par le comportement de préférence sexuelle pour
des partenaires appartenant à la même semi-espèce, comportement
dont le déterminisme génétique ne met probablement en jeu
que peu de gènes). Chez les espèces " jumelles", un remplacement
d'allèles s'était produit au niveau de 58 gènes sur 100.
Et entre espèces morphologiquement distinctes, 100 % des gènes
ne présentaient plus du tout les mêmes variantes. GROUPE
DE DROSOPHILA
WILLISTONI
| | D.
paulistorum | | Drosophila
paulistorum | | | Drosophila
paulistorum | | Drosophila
paulistorum | | | Drosophila
paulistorum | | Drosophila
paulistorum | | Drosophila
paulistorum | | D.
pavlovskiana | | Drosophila
pavlovskiana | | D.
equinoxialis | | Drosophila
equinoxialis equinoxialis | | | Drosophila
equinoxialis caribbensis | | | D.
insularis | | Drosophila
insularis | | D.
tropicalis | | Drosophila
tropicalis tropicalis | | |
Drosophila tropicalis cubana | | | D.
willinstoni | |
Drosophila willistoni willistoni | |
Drosophila willistoni quechua |
Isolement reproductif incomplet, pas d'isolement éthologique
Isolement
reproductif incomplet, isolement éthologique
Stade
espèce, isolement reproductif complet |
Cette
différenciation génétique croissante allait de pair avec
une difficulté croissante de la réussite des croisements: les
membres de races différentes au sein d'une espèce n'avaient aucune
difficulté à se croiser; avec les membres de sous-espèces
différentes, de légers problèmes de stérilité
commençaient à apparaître; ils devenaient plus nets avec les
semi-espèces; et la stérilité totale caractérisait
les croisements entre espèces jumelles.
(M. Blanc, Les Héritiers
de Darwin, Seuil, 1990) Les
espèces jumelles
Preuve
absolue, observée dans la nature, de l'évolution  Lorsque la mouche Drosophila
pseudoobscura fut découverte et décrite on se rendit
compte que le croisement de certains individus produisait des mâles stériles
tandis que les femelles étaient fertiles. Il existait donc en son sein
deux catégories d'individus que l'on regroupa sous le terme de race A et
race B.
Lorsque la mouche Drosophila
pseudoobscura fut découverte et décrite on se rendit
compte que le croisement de certains individus produisait des mâles stériles
tandis que les femelles étaient fertiles. Il existait donc en son sein
deux catégories d'individus que l'on regroupa sous le terme de race A et
race B.
Rien
dans leur apparence ne permettait au début de les distinguer, cependant
le chromosome de la variété A est en forme
de J et celui de la variété B en forme de V. Dans la
nature les deux "variétés" coexistent sur de vastes territoires
sans que les individus se reproduisent entre eux. A force d'études les
différences morphologiques discrète pour l'oeil humain furent identifiées
(tailles des ailes et appareil reproducteur externe du mâle). On en fit
alors deux espèces différentes : Drosophila pseudoobscura
et Drosophila persimilis. L'écologie des deux espèces
montre également des différences. Drosophila persimis a une
distribution plus nordique, se rencontre plus souvent à une altitude élevée
et montre une préférence pour les températures plus froides.
Les femelles des deux espèces n'atteignent pas la maturité sexuelle
au même âge. Enfin l'amputation des antennes des femelles réduit
fortement leur capacité à reconnaître les mâles de leur
propre espèce la distinction se fait donc à l'odeur. Les deux espèces
représentent donc deux complexes génétiques différents
même si les individus sont d'aspect très semblables : ce sont des
espèces jumelles. Passage
d'une espèce à une autre
Preuve
absolue, observée dans la nature, de spéciation
 Jusqu'en 1937, toujours pas
de preuves directes du passage d'une espèce à une autre. Les travaux
des généticiens des populations avaient déjà établi
qu'il existe une certaine différenciation génétique au sein
des espèces. Autrement dit, l'évolution n'était jusque-là
que la modification génétique des populations à l'intérieur
d'une espèce. Or, ce que l'on entend par " évolution des espèces
" depuis Lamarck et Darwin est bien plus que cela : il s'agit du processus
de passage d'une espèce à une autre, de descendance. Darwin n'avait
apporté sur ce point que des arguments théoriques, des déductions
à partir des hésitations des taxinomistes travaillant sur spécimens,
et une réflexion sur la descendance et les capacités de la sélection
artificielleà modifier les formes des animaux domestiques. L'affirmation
selon laquelle une variété ou une race géographique, approfondissant
sa différenciation génétique, donnait une nouvelle espèce,
n'était qu'une extrapolation théorique.
Jusqu'en 1937, toujours pas
de preuves directes du passage d'une espèce à une autre. Les travaux
des généticiens des populations avaient déjà établi
qu'il existe une certaine différenciation génétique au sein
des espèces. Autrement dit, l'évolution n'était jusque-là
que la modification génétique des populations à l'intérieur
d'une espèce. Or, ce que l'on entend par " évolution des espèces
" depuis Lamarck et Darwin est bien plus que cela : il s'agit du processus
de passage d'une espèce à une autre, de descendance. Darwin n'avait
apporté sur ce point que des arguments théoriques, des déductions
à partir des hésitations des taxinomistes travaillant sur spécimens,
et une réflexion sur la descendance et les capacités de la sélection
artificielleà modifier les formes des animaux domestiques. L'affirmation
selon laquelle une variété ou une race géographique, approfondissant
sa différenciation génétique, donnait une nouvelle espèce,
n'était qu'une extrapolation théorique.
L'ornithologue
Ernst Mayr apporta cette preuve en étudiant la distribution géographique
de nombreuses espèces d'oiseaux de par le monde, et notamment dans les
îles du Pacifique. Il rapporta de nombreux exemples d'observations de populations
d'oiseaux où l'on pouvait voir le passage " sur le terrain "
d'une espèce à une autre, dont le plus célèbre exemple,
devenu un classique de la théorie néo-darwinienne, ne concerne pas
les oiseaux du Pacifique, mais des oiseaux d'Europe, d'Asie et d'Amérique
du Nord : les goéland argenté (Larus
argentatus) et goéland brun
(Larus fuscus).
 |
| Larus
fuscus | | Larus
argentatus | | Le
goéland argenté (à droite) est un gros oiseau blanc
aux pattes roses, dont le dessus des ailes est gris-bleu (65 cm de long, 1,40
m d'envergure). Sa distribution géographique part du nord-est de la Sibérie
jusqu'au Kamtchatka, gagne l'Amérique du Nord, pour revenir, via l'Atlantique,
sur les côtes européennes de la mer du Nord et de la Baltique.
Le goéland brun (à gauche) est plus petit (50 cm de long
pour 1,30 m d'envergure); son corps est blanc lui aussi mais avec le dessus des
ailes brun et des pattes jaunes. Sa distribution est limitée aux côtes
de la mer du Nord et de la Baltique, où il se retrouve avec le goéland
argenté. Le
goéland brun est en fait une espèce descendant du goéland
argenté par évolution, et il existe au nord de la Russie et de la
Sibérie une population de goéland qui est d'apparence extérieure
intermédiaire entre les deux espèces: les taxinomistes lui ont donné
le statut de sous-espèce mais la classent ou bien avec Larus argentatus,
ou bien avec Larus fuscus. Il s'agit donc de Larus argentatus heuglini
pour certains auteurs; ou de Larus fuscus heuglini pour d'autres
auteurs. Comment débrouiller cette situation complexe? Heureusement, les
naturalistes, et en particulier Ernst Mayr, ont établi, grâce à
leurs observations sur les populations naturelles, une définition biologique
de l'espèce: une espèce est formée par les populations dont
les membres s'entre-croisent de manière habituelle (c'est une communauté
sexuelle exclusive). Cela signifie qu'à l'inverse dès l'instant
où l'on n'observe pas de croisement régulier entre deux populations,
on a affaire à deux espèces distinctes. Ainsi les populations de
Larus argentatus et de Larus fuscus se comportent comme des espèces
parfaitement distinctes sur les côtes de la mer du Nord et de la Baltique:
elles occupent à peu près les mêmes lieux (sommets des falaises,
etc.), mais leurs membres ne se croisent pratiquement jamais. Ce n'est pas encore
des espèces cloisonnées génétiquement : en captivité
on peut les faire s'accoupler et obtenir des hybrides eux-mêmes fertiles.
Ce qui indique bien que Larus argentatus et Larus fuscus sont des
espèces très voisines, dont les patrimoines génétiques
ont peu divergé. En fait, Si ces deux espèces ne se croisent pas
dans la nature, c'est qu'elles n'ont pas exactement le même comportement,
ni le même mode de vie: - Le
goéland argenté est agressif, sédentaire, mange tous les
déchets rejetés par la mer
-
Le goéland brun est timide, migrateur, et se nourrit essentiellement de
poissons.
- En
outre, quand les deux espèces font des nids dans un même lieu, les
membres de chacune d'entre elles se regroupent entre eux.
Tout
cela conduit Larus argentatus et Larus fuscus à ne pratiquement
jamais se croiser et c'est ce que Mayr appela la spéciation géographique
(ou encore allopatrique). Selon
ce modèle explicatif, une espèce est composée de nombreuses
populations distribuées sur un territoire plus ou moins vaste: elles
peuvent être suffisamment différenciées pour être considérées
comme des races ou des sous-espèces. Certaines de celles-ci, par le hasard
des migrations, peuvent être conduites à occuper une région
éloignée, séparée du territoire d'origine par une
barrière géographique: chaîne de montagnes, détroit,
rivière, grand lac... Cette population, Si elle trouve alors des conditions
de milieu assez différentes de celles prévalant pour le reste de
l'espèce, va présenter des modifications génétiques
l'adaptant à un nouveau milieu (par le jeu de la sélection des allèles
les plus avantageux).
(M. Blanc, Les Héritiers de Darwin,
Seuil, 1990) Oour
polaire et ours brun
Preuve
à conviction d'une spéciation inachevée  Les
deux espèces d'ours représentées ci-dessous, l'Ours polaire,
(Ursus maritimus) et l'Ours brun (Ursus
arctos) habitent tous les deux l'hémisphère Nord. Le
premier les régions circumpolaires arctiques, le deuxième la frange
inférieure jusqu'aux climats tempérés. Ces deux espèces
sont nettement distinctes et leur habitat ne se recoupe pas. Anciennement, l'ours
blanc était même classé dans un genre distinct, le genre Thalarctos.
Les
deux espèces d'ours représentées ci-dessous, l'Ours polaire,
(Ursus maritimus) et l'Ours brun (Ursus
arctos) habitent tous les deux l'hémisphère Nord. Le
premier les régions circumpolaires arctiques, le deuxième la frange
inférieure jusqu'aux climats tempérés. Ces deux espèces
sont nettement distinctes et leur habitat ne se recoupe pas. Anciennement, l'ours
blanc était même classé dans un genre distinct, le genre Thalarctos.

[ Agrandir l'image
]
Et
pourtant, malgré leurs évidentes différences morphologiques,
les zoologues et systématiciens ont dû réviser leur classification
: un couple composé d'un ours blanc et un ours brun, tous deux en captivité
dans un cirque, donnèrent naissance à de petits oursons en parfaite
santé qui furent même capables de se reproduire ! Ce qui n'est pas
le cas lorsque deux espèces, pourtant très proches comme par exemple
une lionne et un tigre, ont une descendance hybride nommée tigron : le
bébé hybride se portera généralement bien, mais sera
incapable de se reproduire avec un individu de l'espèce souche.
La
spéciation de l'ours polaire est donc très récente, peut-être
moins de 200 000 ans, époque où survint la séparation d'un
petit groupe d'ours bruns puis une "rapide" adaptation de ceux-ci à
la vie dans un environnement de glaces. Par la nette divergence évolutive
de ces deux ours - géographique, morphologique, éthologique, etc.
- les systématiciens continuent donc à les considérer comme
deux espèces différentes.
Notons qu'avec cet exemple d'une
des plus remarquables et récentes spéciations connues, c'est aussi
une des plus "arbitraires" distinctions, car vraiment à la frontière
entre espèce et sous-espèce, que nous puissions constater.  Questions
aux créationnistes et tenants du "dessein intelligent" :
Questions
aux créationnistes et tenants du "dessein intelligent" :
Cette
spéciation de l'ours blanc et son interfécondité avec l'ours
brun n'est explicable que par l'évolution, est-ce un amusant pied de nez
aux espèces bien séparées de l'arche de Noé, ou le
sens de l'humour divin ?
Rafael
Terrón |

